Problema 12.5.11
In un cilindro verticale retto con pareti adiabatiche e basi adiabatiche può scorrere, senza attrito e a tenuta, un pistone cavo di peso e capacità termica trascurabili, ma conduttore di calore (fig.12.14). La parte superiore del cilindro attraverso un foro è in comunicazione con l’aria esterna (paria=1,0atm, taria=27°C).
Calcolare:
Inizialmente il pistone si trova bloccato all’altezza h1 = 80cm dal fondo e chiude nella parte inferiore del cilindro V1=4,0l di gas (O2) alla pressione p1=0,5atm e alla temperatura t1=227°C.
a) Il pistone viene caricato con m=8,264Kg di ghiaccio fondente e rimane bloccato, mentre il gas cede il calore Q1,2 fino all’equilibrio termico col ghiaccio, fondendone la massa Δm.
b) Il pistone viene liberato e scende immediatamente, senza permettere scambi di calore, fino ad h3 in una posizione di equilibrio meccanico.
c) Il pistone continua a scendere lentamente fino ad h4, mentre il gas si raffredda, cedendo il calore Q3,4, fino alla temperatura di equilibrio e vi rimane fintanto che, togliendo il coperchio del cilindro, il ghiaccio non è tutto fuso.
Calcolare:
1) le altezze h3, h4;
2) il lavoro e la variazione di entropia nelle singole trasformazioni (1,2; 2,3; 3,4) del gas;
3) la massa Δm di acqua formatasi durante la trasformazione (1,2) e la variazione di entropia del sistema ghiaccio- acqua
|
1) Il gas è biatomico:
Supponendo le trasformazioni reversibili vedi figura. 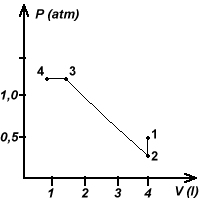 2) L12=0 (isocora) 3) La massa di ghiaccio sciolta è Δm=-Q12/Cl dove Cl=79,4cal/g è il calore latente di fusione del ghiaccio. I principi della termodinamica valgono per qualunque sistema termodinamico e non solo per i gas perfetti. Abbiamo utilizzato nei problemi precedenti i gas perfetti, perchè di essi eravamo in grado di conoscere l’eq. di stato. |