Problema 12.4.8
In un cilindro retto verticale, di sezione S=500cm2, chiuso superficialmente da un pistone del peso P=5090N (fig.12.19)sono contenute n=0,5 moli di azoto N2 alla temperatura T1=300K.
Il gas viene riscaldato fornendo la quantità di calore Q1,2=2,08Kcal e contemporaneamente il pistone passa dalla posizione a) alla posizione b).
Si blocca il pistone nella posizione b) e si raffredda il gas fino a che ritorna nella temperatura iniziale T1.
Tanto il cilindro che il pistone vengono isolati adiabaticamente, poi si lascia libero il pistone che scenderà fino a raggiungere nella posizione c) le condizioni di equilibrio.
Il gas viene poi raffreddato fino a tornare nello stato iniziale, con il pistone nella posizione a).
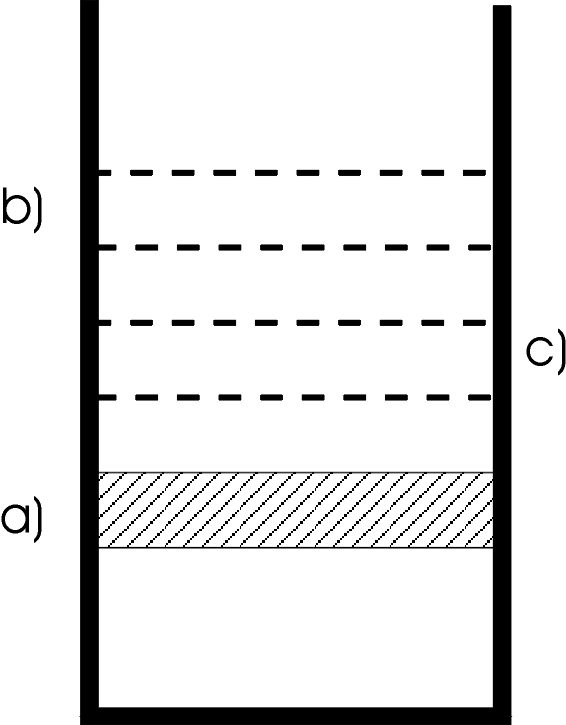
Calcolare i volumi occupati dal gas, quando il pistone si trova rispettivamente nelle posizioni a), b), c), il lavoro fatto nelle singole trasformazioni e le quantità di calore scambiate con l’ambiente esterno.
La pressione atmosferica vale durante tutto il ciclo p0=1,0atm.
|
n=0,5moli a) p1=p0+pS (pressione di equilibrio iniziale del gas)
b) Vedi Cap.12.3.
V3=V2 (trasf. isocora)
Si può anche calcolare p3,considerando l’isoterma 1,3 (vedi figura): 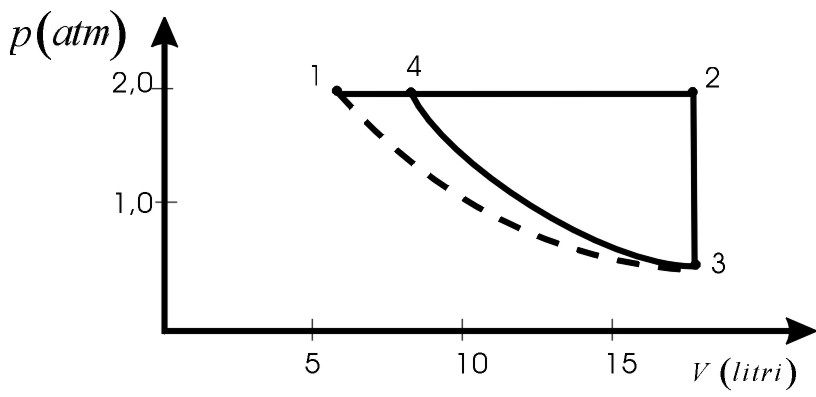
In a) il volume è V1=6,15l, in b) V2=V3 =18,5l, in c) V4=8,45l. fig.12.20 L1,2=p1(V2-V1)=24,7l.atm [isobara (Cap.12.2a)] |