Problema 12.5.4
Due gas, inizialmente alla stessa pressione p0 e stessa temperatura T0, sono compressi da un volume V0 ad un volume V0/2, uno isotermicamente, l’altro adiabaticamente. Discutere su quale dei due gas la pressione finale sarà più grande. Calcolare il lavoro speso nei due casi, sapendo che in ambedue si tratta di una mole di gas biatomico.
Vedi figura.
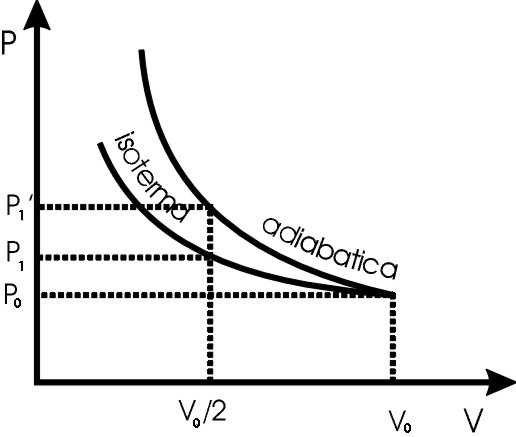
1) La pressione sarà maggiore per il gas compresso adiabaticamente.
p0V0=nRT0
T0=p0V0/nR
T0=cost (isoterma)
p1’/p0=V0/V1’
Se il volume si è dimezzato, la pressione è raddoppiata:
p1=2p0
p1’V1’γ =p0V0γ (adiabatica)
p1’=p0(V0/V’1)γ
p’1=2γ p0
γ >1
p1’>p1
2) Dal grafico si vede che il lavoro di compressione è maggiore nell’adiabatica che nell’isoterma.
Per l’isoterma (Cap.12.2 c)):
L=nRT0lnV1/V0
n=1
T0=p0V0/R
L=p0V0ln0,5=-0,69p0V0<0 (compressione)
Per l’adiabatica:
L=-ΔU=-nCvΔT
n=1
Cv=5R/2
γ =1,4 (gas biatomico)
T0V0γ -1=T1V1γ -1
L’=-Cv(T1-T0)
L’=-(5R/2) (p0V0/R)(2γ-1-1) <0 (compressione)
L’=-2,5.0,32.p0V0=-0,8p0V0
L’>L (in valore assoluto)