Problema 12.4.6
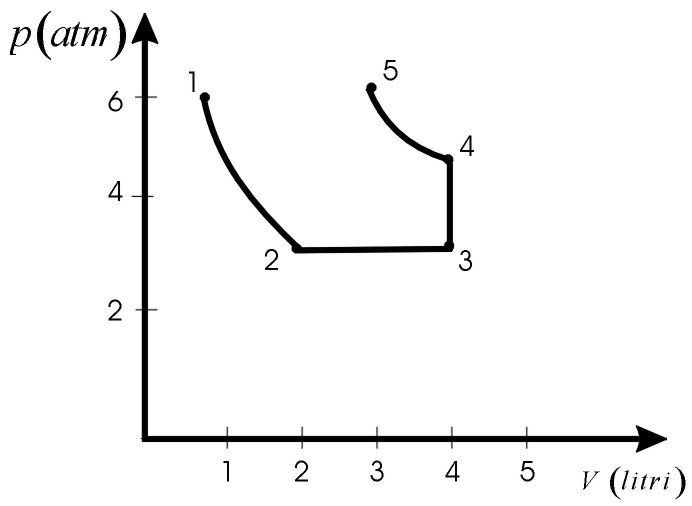
Una massa m=8g di O2, inizialmente alla temperatura T1=300K, occupa un volume V1=1,0l. Riferendoci alla fig.12.9 si ha che:
1-2 e 4-5 sono trasformazioni isotermiche
2-3 è una trasformazione isobara
3-4 è una trasformazione isocora
4-5 è una trasformazione isotermica
a) Calcolare i valori di p,V,T negli stati 1, 2, 3, 4, 5, sapendo che:
V2=2V1
V3=2V2
p4=3/2 p3
p5=p1
b) Calcolare la variazione di energia interna, il lavoro e lo scambio di calore con l’ambiente per ogni trasformazione, supposte reversibili.
|
n=m/M=0,25moli a) Applichiamo l’equazione caratteristica dei gas perfetti (Cap.12.1) pV=nRT e calcoliamo le coordinate termodinamiche corrispondenti ai rispettivi stati.
1-2) isoterma: 2-3) isobara: 3-4) isocora: 4-5) isoterma: |