Problema 12.4.5
n=0,5 moli di un gas perfetto monoatomico si trovano inizialmente alla temperatura T1=300K ed occupano un volume V1=2,0l.
Il gas viene poi fatto espandere a temperatura costante fino ad occupare un volume V2=3,0V1.
Mantenendo costante la pressione il gas viene fatto espandere ulteriormente fino ad occupare un volume V3=2V2.
Esso viene poi compresso a volume costante fino a raggiungere una pressione p4=3/2 p3.
Infine a temperatura costante è ulteriormente compresso fino a che la sua pressione ritorna al valore iniziale p1.
a) Determinare i valori di p,V,T negli stati 1, 2, 3, 4, 5.
b) Calcolare la variazione di energia interna nelle singole trasformazioni.
|
Vedi Problema 12.4.4. a) Calcolo le coordinate termodinamiche
Come si vede in figura non è un ciclo. 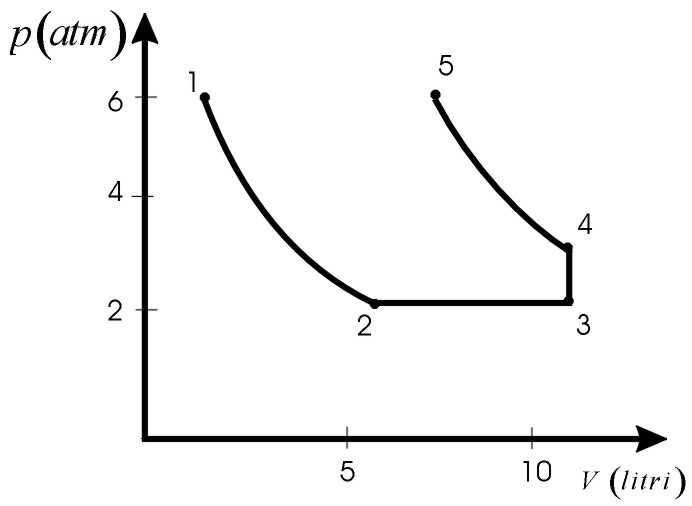 b) Vedi Problema 12.4.1. |